2011年3月,日本福岛核电站发生核泄漏,核泄漏的放射性物质中,大量存在一种叫做“碘-131”的放射性元素。传说吃含碘食品或服碘片可以减缓碘-131对人体的影响,有些人就去抢购碘盐、碘片。下表是某食用碘盐包装袋上的部分说明:
| 配 料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
| A.碘酸钾可氧化氯化钠 | B.只用淀粉就能检验碘盐中的碘酸钾 |
| C.高温会导致碘的损失 | D.该碘盐中碘酸钾含量约为34~84mg/kg |
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极材料为 。
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4 K2SO4+ I2+ H2O
K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-→2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
有机物A、B、C、D、E、F、G的相互转化关系如下图所示。5.2 g的F能与100 mL 1 mol/L NaOH溶液恰好完全中和;0.1 mol的F还能与足量金属钠反应,在标准状况下放出2.24 L H2;D的分子式为C3H3O2Na;E的分子中含有羧基。
则A、D、E、F、G的结构简式依次为AD.
EFG
X原子在第二电子层上只有一个空轨道,其电子排布式为;R原子的3p轨道上只有一个未成对电子,则R原子可能是、;Y原子的核电荷数为29,元素符号为,其价电子构型是,该元素在元素周期表中的位置是,是属于区的元素。
(1)向盛有硫酸铜水溶液的试管里逐渐滴加氨水至过量,观察到的实验现象是:其反应的离子方程式为:、
(2)利用VSEPR理论推测下列分子或离子的空间构型:CO32-和SO32-的空间构型分别为、和。其中心原子的杂化方式分别是和
分子式为C2H6O的化合物A具有如下性质: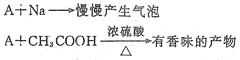
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作。
(3)A与钠反应的化学方程式:。
(4)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制A的化学方程式:。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为。
(2)W与Y可形成化合物W2Y,该化合物的电子式为。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
。
(4)比较Y、Z气态氢化物的稳定性:>(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是>>
>。