运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: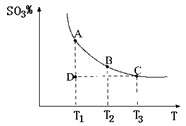
① 2SO2(g)+O2(g) 2SO3(g)是 反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
2SO3(g)是 反应(填吸热或放热);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中 有着重要作用。
有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。
(热量Q的数值用含字母a、b的代数式表示)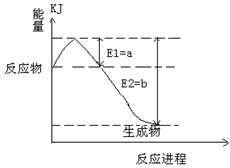
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是 (用离子方程式表示) 。
(用离子方程式表示) 。
(25°C时AgCl和AgI的离子积常数KSP为:
KSP[AgCl]=1.0×10-10 mol2·L-2 , KSP[AgI]=1.5×10-16 mol2·L-2 )
(10分)化合物甲、乙、丙有如下转化关系:
回答:
(1)甲中官能团的名称是________,甲属________类物质,甲可能的结构有________种,其中可催化氧化为醛的有________种.
(2)反应条件①为__________________________________________.
条件②为_______________________________________________.
(3)甲→乙的反应类型为________,乙→丙的反应类型为________.
(4)丙的结构简式不可能是________.
| A.CH3CH2CHBrCH2Br |
| B.CH3CH(CH2Br)2 |
| C.CH3CHBrCHBrCH3 |
| D.(CH3)2CBrCH2Br |
(11分)有A、B、C三种烃的衍生物,相互转化关系如下:
其中B可发生银镜反应,C跟石灰石反应产生能使澄清石灰水变浑浊的气体.
(1)A、B、C的结构简式依次是___________, ___________, ____________.
(2)写出下列反应的化学方程式.
①A→B的化学方程式为:___________________________________________.
②B→C的化学方程式为:___________________________________________.
B发生银镜反应的化学方程式为;__________________________________.
③B→A的化学方程式为:___________________________________________.
(8分)把少量的苯酚晶体放入试管中,加入少量水振荡,溶液里出现________,因为_______________________,逐渐滴入稀NaOH溶液,继续振荡,溶液变为________,其化学方程式为__________________________,向澄清的溶液中通入过量CO2,溶液又变为________,其化学方程式为__________________________.
(6分)根据下面的反应路线及所给信息填空
(1)A的结构简式是____________,名称是________.
(2)①的反应类型是______________;②的反应类型是______________.
(3)反应④的化学方程式是____________________________________________.
(6分)C3H7Cl的结构有两种,分别为CH3CH2CH2Cl和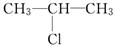
(1)CH3CH2CH2Cl和NaOH水溶液共热发生反应的化学方程式为:__________________,反应类型为________.
(2) 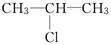 和NaOH乙醇溶液共热发生反应的化学方程式为:_____,反应类型为________.
和NaOH乙醇溶液共热发生反应的化学方程式为:_____,反应类型为________.