工业生产纯碱的工艺流程示意图如下: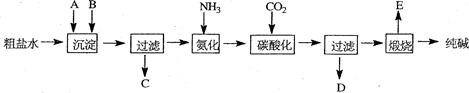
完成下列填空:
(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:取样、 、沉淀、 、 。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象 。碳酸化时没有析出碳酸钠晶体,其原因是 。
(4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法: 。
(5)向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 (填a、b、c字母) 。这样做使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 的循环,这就是有名的侯氏制碱法。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
| 主族 周期 |
ⅠA |
0族 |
||||||
| 一 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 二 |
② |
③ |
||||||
| 三 |
④ |
⑤ |
⑥ |
(1)最活泼的金属元素是(填元素符号),②和⑤两种元素原子半径较大的是(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的元素是(填元素符号);
(2)写出①单质在⑥单质中燃烧的化学方程式。
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢。写出此物质的结构简式:;写出该物质与NaHCO3反应的化学方程式:____________。
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
Ⅰ.若电解质溶液为稀硫酸
(1)Zn棒为原电池的极,其电极反应式为。
(2)Cu棒为原电池的极,其电极反应式为。
Ⅱ.若电解质为硫酸铜溶液,
(3)Cu棒上发生反应。
(4)若在上述两个过程中,转移电子数相等,则Cu棒上Ⅰ和Ⅱ所析出物质的质量之比为。
(8分)请选择合适选项填空(用字母序号填空):
| A.He |
| B.Cu |
| C.H2 |
| D.NaCl |
E.KOH
F.H2O
(1)属于共价化合物的是________;
(2)含共价键的单质有________;
(3)只含有离子键的化合物有________;
(4)既有离子键又有共价键的化合物_________。
下表是元素周期表的一部分:
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是,非金属性最强的元素是。
(2)化学性质最不活泼的元素是,其原子结构示意图为。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是。
Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: |
(1)有机物X的相对分子质量是__________________。 |
| (2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 |
(2)有机物X的分子式是 __________________。 |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3︰1。 |
(3)有机物X的结构简式是 __________________。 |
Ⅱ.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ,
, 是由A(C5H6)和B经Diels-Alder反应制得。
是由A(C5H6)和B经Diels-Alder反应制得。
(1)Diels-Alder反应属于反应(填反应类型):A的结构简式为。
(2)写出与 互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。
互为同分异构体,且一溴代物只有两种的芳香烃的名称:;写出生成这两种一溴代物所需要的反应试剂和反应条件:。