已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图 ,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,则由N2气体生成1mol气态N4的△H为()
,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,则由N2气体生成1mol气态N4的△H为()
| A.+882kJ·mol-1 | B.+441kJ·mol-1 | C.-882kJ·mol-1 | D.-441kJ·mol-1 |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是()
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐降低
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
短周期元素X、Y的原子序数相差2,下列有关叙述不正确的是()
| A.X与Y不可能位于同一主族 |
| B.X与Y不一定位于同一周期 |
| C.X与Y可能形成共价化合物XY |
| D.X与Y可能形成离子化合物XY |
下列离子方程式表示正确的是()
| A.AgNO3溶液中加入Cu :Cu+Ag+=Cu2++Ag |
| B.NaHCO3溶液中加入CH3COOH: CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O |
| C.含0.1mol FeBr2的溶液中通入0.5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合: HCO3-+Ba2++OH-=BaCO3↓+H2O |
某元素的一种同位素X的原子质量数为A,含N个中子,它与2H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
A.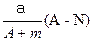 mol mol |
B.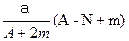 mol mol |
C.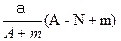 mol mol |
D. mol mol |