第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个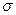 键和1个大
键和1个大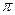 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN) 是一种链状分子,它与异氰酸(HNCO)互为同分异构体
是一种链状分子,它与异氰酸(HNCO)互为同分异构体 ,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2) Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
②六氰合亚铁离子[Fe(CN)6]4-中不存在__________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
并写出一种与 CN_ 互为等电子体的单质分子式______________________。
③三氯化铁常温下为固体,熔点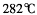 ,沸点
,沸点 ,在
,在 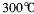 :以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
:以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___________。
(3)①Ti的在周期表中位置______________ 。
根据元素原子的外电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。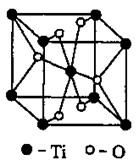
②Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 。工业上利用X和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐),制 备M的化学反应方程式是________________________________________;
备M的化学反应方程式是________________________________________;
用价层电子对互斥理论判断下列物质的空间构型:
① NH4+ ② NH3
③ CCl4④ SO3
(6分)写出下列原子的电子排布式。
(1)S (2)29Cu (3) 26Fe
(1)________________________________________________________________________
(2)________________________________________________________________________
(3)________________________________________________________________________
已知物质A、B、C、D、E、F、G、H、I、J、X、Y有如下图所示的转化关系,其中气体A、B、C为常见非金属单质,X、Y为常见金属单质。(部分反应中生成物没有全部列出,反应条件未全部列出)
请按要求回答下列问题:
(1)气体E的电子式为;
(2)G的化学式是___________;
(3)写出反应“I→J”的离子方程式;
(4)金属X与NaOH溶液反应也能得到溶液H,试写出对应的化学方程式。
(1)(3分)有下列有机物:
a.  b.
b. 
c.  d.
d. 
①互为同分异构体的是_______________。
②互为同系物的是_______________。
③核磁共振氢谱只有一个峰的是_______________。
(2)(6分)柠檬酸结构简式为:
①柠檬酸中的官能团有____________。
②1 mol柠檬酸最多可消耗NaOH溶液的物质的量为_______________mol。
③柠檬酸不能发生的反应为_______________。
a.酯化反应 b.加成反应 c.氧化反应 d.消去反应 反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是(填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是(填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。
①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是(填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于(填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是(填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有性。
②(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是。