KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下: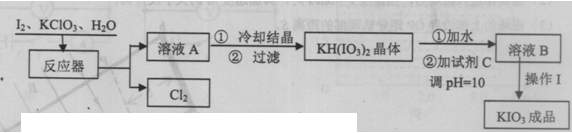
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
( 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
A、B、C、D、E是原子序数依次增大的五种短周期元素,B、E在同一主族,且满足最高正化合价+最低负化合价=0,A与C、D与C之间都可以形成原子个数比分别为2∶1和1∶1的两种化合物,请回答下列问题:
(1) 在A2C2分子中含有的化学键是和;
(2) C与D形成的化合物的电子式为、;
(3) 写出A2C与D2C2反应的化学方程式;
(4) 写出E的氧化物与A、C、D形成的化合物的水溶液反应的离子方程式。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
⑩ |
||||||
| 2 |
⑥ |
⑦ |
||||||
| 3 |
② |
③ |
④ |
⑧ |
||||
| 4 |
⑤ |
⑨ |
请回答下列问题:
(1)十种元素中化学性质最不活泼的是(填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是(填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为(填元素符号),
原因;
(4) 元素⑥的氢化物的化学式为,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈色;
(6)十种元素中(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为。
胡椒酚甲醚(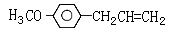 )医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效。根据题意完成下列填空:
)医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效。根据题意完成下列填空:
⑴ 胡椒酚 (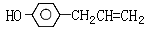 )与甲醇合成升白宁,该反应属于反应。
)与甲醇合成升白宁,该反应属于反应。
在水中的溶解度:胡椒酚苯酚。(填:大于、等于或小于)
⑵ 写出升白宁分子中不含氧原子的官能团的名称。
⑶ 胡椒酚有多种同分异构体,其中能发生银镜反应且苯环上的一溴代物有两种的芳香族化合物的结构简式:(任写两种)。
⑷ 写出升白宁与溴水反应的化学反应方程式:。
Ⅰ、根据下面的反应线路及所给信息填空。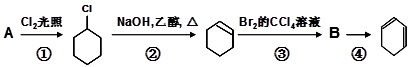
(1)B的结构简式是;
(2)④的反应类型是;
(3) 写出反应①的化学方程式;
Ⅱ、工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
(1)甲的结构简式;(3)的化学方程式是________ __________。
写出下列有机物的结构简式或名称:
⑴ 间甲基苯乙烯,⑵ 苯甲酸乙酯,
⑶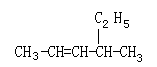 ,⑷
,⑷ 。
。