下列离子方程式不正确的是( )
| A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O |
| B.将Na2O2固体投入H218O中:2H218O+2Na2O2===4OH-+4Na++18O2↑ |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO完全沉淀: 2Ba2++NH+Al3++2SO+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO+20H+===4Fe3++3O2↑+10H2O |
下列反应的离子方程式正确的是()
A.稀硫酸滴在银片上:2Ag+2H+ 2Ag++H2↑ 2Ag++H2↑ |
B.稀硫酸与氢氧化钡溶液混合: +Ba2+ +Ba2+ BaSO4↓ BaSO4↓ |
C.稀硝酸滴在大理石上:CaCO3+2H+ Ca2++H2CO3 Ca2++H2CO3 |
D.氧化铁与稀盐酸混合:Fe2O3+6H+ 2Fe3++3H2O 2Fe3++3H2O |
下列方程式不能用Ba2++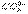
 BaSO4↓来表示的是()
BaSO4↓来表示的是()
A.Ba(NO3)2+H2SO4 BaSO4↓+2HNO3 BaSO4↓+2HNO3 |
B.BaCO3+H2SO4 BaSO4↓+CO2↑+H2O BaSO4↓+CO2↑+H2O |
C.Na2SO4+BaCl2 BaSO4↓+2NaCl BaSO4↓+2NaCl |
D.BaCl2+H2SO4 BaSO4+2HCl BaSO4+2HCl |
重金属离子具有毒性。实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是( )
| A.Cu2+和SO42- | B.Cu2+和Cl- | C.K+和SO42- | D.Ag+和NO3- |
离子方程式H++OH-=H2O所表示的反应是()
| A.所有酸和碱之间的中和反应 |
| B.所有强酸和强碱之间的反应 |
| C.所有可溶性酸和可溶性碱之间的中和反应 |
| D.强酸溶液与强碱溶液生成可溶性盐和水的反应 |
下列物质中,导电性能最差的是()
| A.熔融的氢氧化钠 | B.石墨棒 | C.盐酸溶液 | D.固态氯化钾 |