下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O Fe(OH)3↓+ 3H+ Fe(OH)3↓+ 3H+ |
| B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓ |
| C.钠与水反应:Na+2H2O=Na++H2↑+OH- |
| D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br- |
亚硫酰氯(SOCl2)是重要的有机物卤化剂和电池的介质,生产上和生活中有着广泛应用,亚硫酰氯易水解,在140℃以上可发生:4SOCl2=3Cl2↑+2SO2↑+S2Cl2。有关说法不正确的是
| A.1mol SOCl2受热分解,转移2mol电子 |
| B.S2Cl2分子中各原子均达到八电子结构 |
| C.气态产物通入品红溶液中,一定能使品红溶液褪色 |
| D.工业上用ZnCl2·6H2O与SOCl2混合制无水氯化镁,是利用SOCl2水解释放出HCl, |
抑制氯化锌的水解
下列实验操作或实验设计正确的是
| A.用碱式滴定管准确取出25.00mL 1 mol/L高锰酸钾溶液 |
| B.将溴丙烷与足量氢氧化钠溶液混合加热,冷却后加 硝酸银溶液,检验其中溴元素 |
| C.用氢氧化钠固体与稀盐酸混合,测量混合前后温度变化, 证明中和反应是放热反应 |
| D.用右图装置干燥氨气, |
向下列含有Na+、SO42-的溶液中通入足量的SO2后,该溶液中还可能大量存在的离子组是
| A.NH4+、Mg2+、Cl- | B.Fe3+、H+、Br- |
| C.Mg2+、ClO-、NO3- | D.Na+、CO32-、S2— |
下列叙述正确的是
|
| A.过氧化钠的电子式 | B.光导纤维主要成分为:SiC |
C.146C与147N互为同位素 | D.S2-结构示意图为: |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是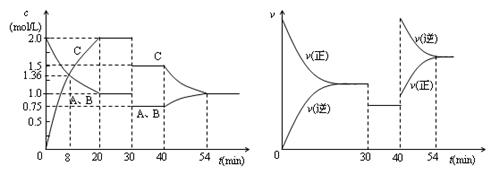
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为4 |