(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O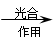 C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图t1时引起平衡移动的条件可能是 。
其中表示平衡混合物中NH3含量最高的一段时间是 。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为 。
下列反应的离子方程式不正确的是
| A.铁与硫酸铜溶液反应: Fe + Cu2+ = Fe 2+ + Cu |
| B.镁与稀盐酸反应: Mg + 2H+ = Mg 2+ + H2↑ |
| C.氢氧化钙溶液与盐酸反应: OH-+ H+ = H2O |
D.氢氧化钡溶液与硫酸反应: Ba2+  +SO42-= BaSO4↓ +SO42-= BaSO4↓ |
关于容量瓶的使用,下列操作正确的是
| A.使用前要检验容量瓶是否漏液 |
| B.用蒸馏水荡洗后必须要将容量瓶烘干 |
| C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
D.为了使 所配溶液浓度均匀,定容后,手握瓶颈,左右振荡 所配溶液浓度均匀,定容后,手握瓶颈,左右振荡 |
下列各组中的离子,能在溶液中大量共存的是
| A.Ca2+、H+、Cl-、Ag+ | B.Cu2+、OH-、SO42-、K+ |
| C.Ba2+、OH-、NO3-、Na+ | D.K+、CO32-、Ba2+、Cl- |
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B .CH4的摩尔质量为16g
.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
下列物质中,属于电解质的是
| A.CO2 | B.铁 | C.CuSO4 | D.NaCl溶液 |