相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:
2XY2(g)+Y2(g)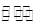 2XY3(g),
2XY3(g), 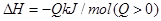
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| 编号 |
XY2 |
Y2 |
XY3 |
|
| ① |
2 |
1 |
0 |
放热0.25QkJ |
| ② |
1.2 |
0.6 |
0.8 |
|
下列叙述不正确的是
A.达到平衡时,①和②两容器中气体的平均相对分子质量相同
B.容器②中反应达到平衡时放出的热量为0.15 Q kJ
C.达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol·L-1
D.若容器①的其他条件不变,只增加1mol稀有气体,则达到平衡时放出的热量等于0.25 Q kJ
23Na与23Na+比较,相同的是
| A.微粒半径 | B.化学性质 | C.最外层电子数 | D.中子数 |
已知某元素的原子序数,则不能推出该元素原子的
A. 质子数 质子数 |
B.中子数 | C.电子数 | D.核电荷数 |
在人类已知的化合物中,种类最多的是
A 过渡元素的化合物 B第ⅡA族元素的化合物
C 第ⅢA族元素的化合物 D第ⅣA族元素的化合物
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
A,B两元素为某周期ⅡA族和ⅢA族元素, 若A的原子序数为x,则B的原子序数可能是
①x+1②x+81③x+11④x+18⑤x+25
| A.①③ | B.②④ | C.①③⑤ | D.②③④⑤ |