为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_____________________________________________
探究活动Ⅱ的实验现象为_______________________________________________
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 |
现象和结论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] |
若_________,则猜想一不成立。 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙 醚,充分振荡、静置分层 |
若乙醚层呈血红色,则___________。 |
②写出实验操作“步骤—"中反应的离子方程式:_______________________________。
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液作指示剂,再用c mol/L KI标准溶液 滴定,达到滴定终点时的现象是_______________________________________________。
②重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则FeCl3稀溶液物质的量浓度为________mol/L。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ (填“偏高”或“偏低,,或“不变”)。
铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。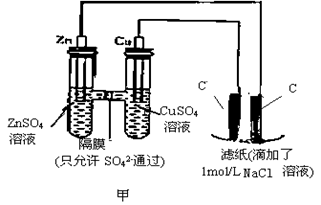
用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题: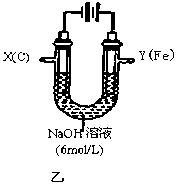
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
利用I2O5可消除CO污染或定量测定CO,反应为:
5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH1
5CO2(g)+I2(s);ΔH1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH2
2CO2(g);ΔH2
2I2(s)+5O2(g) 2I2O5(s);ΔH3
2I2O5(s);ΔH3
则ΔH 1= (用含ΔH2和ΔH3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答: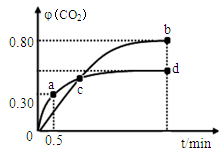
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(3)将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
(1)试管C中苯的作用是:_____________________________________。
反应开始后,观察D和E两试管,看到的现象为: D ______________; E__________________________。
(2)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是________________________________。
(3)在上述整套装置中,具有防倒吸的仪器有______________________________(填字母)。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
(1)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如图),取出铜丝,可以观察到铜丝表面 。
(2)写出乙醇与氧气催化氧化的化学反应方程式 。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可) 。
用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
根据以上材料和你所学的化学知识回答下列问题:
(1)丙烯醛(CH2=CHCHO)中含有的官能团____________________(填名称)。
(2)A与B合成丙烯酸乙酯的化学方程式是__________ 。
(3)由石油裂解产物丙烯合成聚丙烯塑料的化学方程式是: 。