某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为 。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有 证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如右图装置中处理足够时间。
Ⅱ检验过程
| 操作 |
现象及结论 |
| 基于方案一: |
|
| 基于方案二: |
|
(1)向KAl(SO4)2溶液中滴加过量氨水,现象是____________________________,反应的离子方程式______________________________________________,再向其中加入过量NaOH溶液,反应现象是____________________________________________,反应的离子方程式为_______________________________________________。
(2)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图象的序号填入表中。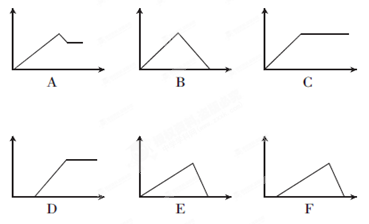
| 溶液 |
加入的物质 |
答案序号 |
| ①饱和石灰水 |
通过量CO2 |
|
| ②AlCl3溶液 |
通过量NH3 |
|
③MgCl2、AlCl3混合溶 液 液 |
逐滴加NaOH溶液至过量 |
|
| ④AlCl3溶液 |
逐滴加NaOH溶液至过量 |
|
| ⑤含少量HCl的AlCl3溶液 |
逐滴加NaOH溶液至过量 |
.某学生课外活动小组,模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0—50 mL),供量气用;乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试完成下列问题:
(1)图中各装置接口连接顺序是_____(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的反应物是__________和__________。
(3)装置D中发生的化学反应方程式
(4)装置A的作用是___________________________________________________________,装置B的作用是___________________________________________________________。
(5)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意__________和__________(填字母编号)。
a.视线与凹液面最低处相平 b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平 d.读数时不一定使甲、乙两管液面相平
(6)反应结束后,测得产生的气体标准状况下体积为22.4 mL,则反应过程中转移的电子数目为。
(13分)红砖是用粘土高温烧结而成,因其颜色呈红色或棕红色而得名,常用作建筑材料。
(1)根据红砖的颜色、猜测其可能含有的成份是(写化学式)
(2)为了检验你的猜测是否正确,请设计一个实验方案,简要地写出各步操作过程以及最后的实验分析和结论,涉及化学反应的写出化学方程式(实验用品任取,该实验分几步自己决定,不必写实验装置中的仪器安装)
实验步骤:①用铁锤敲碎红砖,取小块磨成粉末。
②
③
┇
┇
实验分析及结论:
(3)红砖曾对我国建设起到重要作用,就目前我国实际情况看,你是认为应继续使用或者
是禁止使用红砖?,理由是
。
苯与液溴制取溴苯
(1)溴苯制取的化学反应方程式: ;
;
(2)装置A的名称是:
(3)冷凝管作用:,冷凝水顺序:(a、上进下出 b、下进上出)。
(4)B装置导管位置为什么要处于如图所示位置,而不能伸入液面以下,请解释原因:
(5)实验结束后,得到粗溴苯要用如下操作提纯,①蒸馏;②水洗;③用干燥剂干燥;④用10% NaOH溶液洗;⑤分液。正确的操作顺序是()
| A.⑤④②①③ | B.④②⑤③① |
| C.④②⑤①③ | D.④⑤③①② |
下图是一套制取并验证氯气部分化学性质的实验装置。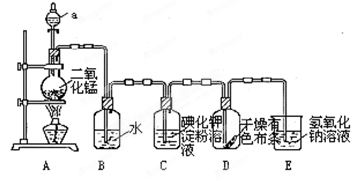
回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为____。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为____色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____________。
(5)装置E的作用是________。并写出该反应的化学方程式:。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ____________;