向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。
则下列关系不正确的是
A.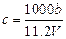 |
B. |
C.n="m+17Vc" | D.5m/3< 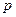 < 17m/9 < 17m/9 |
设nA为阿伏加德罗常数的数值, 下列说法正确的是
下列说法正确的是
| A. 30gC2H6中含有6nA个C-H键 | B.1mol·L-1NaCl溶液中含有nA个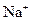 |
| C. 1mol Cu和足量稀硝酸反应产生nA个NO分子 | |
| D.常温常压下,22.4L CO2中含有nA个CO2分子 |
下列叙述正确的是
A.Li在氧气中燃烧主要生成Li2O2
B.将SO2通入BaCl2溶液可生成BaSO3沉淀
C .将CO2通入次氯酸钙溶液可生成次氯酸
.将CO2通入次氯酸钙溶液可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
下列关于电解质溶液的正确判断是
A.在pH = 12的溶液中, 、 、 、 、 、 、 可以大量共存 可以大量共存 |
|
B.在pH= 0的溶液中, 、 、 、 、 、 、 可以大量共存 可以大量共存 |
|
C.由0.1 mol· 一元碱BOH溶液的pH=10,可推知BOH强碱 一元碱BOH溶液的pH=10,可推知BOH强碱 |
D.由0.1 mol· 一元酸HA溶液的pH=3, 可推知NaA溶液呈碱性 一元酸HA溶液的pH=3, 可推知NaA溶液呈碱性 |
电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
| A.0.10mol/LAg+ | B.0.02mol/L Zn2+ |
| C.0.20mol/L Cu2+ | D.0.20mol/L Pb2+ |
下列指定微粒的个数比为1︰2的是
A Be2+离子中的质子和电子 B氘原子中的中子和质子
C NaHCO3晶体中的阳离子和阴离子 D Na2O2固体中的阴离子和阳离子