下列推断正确的是
| A.SiO2 是酸性氧化物,能与NaOH溶液反应 |
| B.Na2 O、Na2 O2组成元素相同,与 CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
25℃时,下列关于分别由等体积0.1 mo1/L的2种溶液混合而成的溶液的说法中,不正确的是
| A.Ba(OH)2溶液与Na2SO4溶液:pH=13 |
| B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO一)+c(OH一) |
| C.Na2CO3溶液与NaOH溶液:c(Na+)>c( CO32-)>c(OH一)>c(H+) |
| D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铝制饮具最好不要盛放酸性、或碱性较强的液体食物 |
因为Al和Al2O3既可以与酸反应、又可以与碱反应 |
Ⅰ对,Ⅱ对,无 |
| B |
氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色 |
说明次氯酸的氧化性比氯气强 |
Ⅰ对,Ⅱ对,无 |
| C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的黄光 |
Ⅰ对,Ⅱ对,无 |
| D |
铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸 |
因为铁和铝不能与浓硫酸或浓硝酸反应 |
Ⅰ对,Ⅱ对,有 |
赫克反应、根岸反应和铃木反应已成为化学家们制造复杂化学分子的“精致工具”,在科研、医药和电子等领域已经广泛应用。下例是由铃木反应合成出来的一种联苯的衍生物 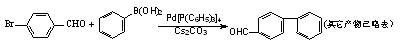
下列叙述正确的是
| A.1 mol该联苯的衍生物在一定条件下最多可和7 mol H2发生加成反应 |
| B.该联苯的衍生物属于芳香烃 |
| C.该联苯的衍生物苯环上的一硝基取代产物有7种 |
| D.该反应为加成反应,且原子利用率达100% |
发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理如右图,其总反应式为:H2+2NiOOH 2Ni(OH)2。下列有关混合动力车的判断正确的是
2Ni(OH)2。下列有关混合动力车的判断正确的是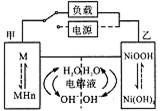
| A.在上坡或加速时,乙电极周围溶液的pH将减小 |
| B.在上坡或加速时,溶液中的K+向甲电极迁移 |
C.在刹车和下坡时,甲电极的电极反应式为:2 H2O+2e- |
| D.在刹车和下坡时,乙电极增重 |
短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素非金属性:Z> Y > X | B.最高价氧化物水化物酸性:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |