恒温恒压下1 mol A和n mol B在一个容积可变的容器中发生如下反应:
A(g) 2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
2B(g) + 2C(g),一段时间后达到平衡,生成a mol C。则下列说法中正确的是
A.物质A、B的转化率之比一定是1∶2
B.若起始时放入3 mol A+3n mol B,则达平衡时生成3a mol C
C.起始时刻和达平衡后容器中的压强比为 (1+n)/(1+n-a/ 2)
2)
D.当v正(A) =2v逆(C)时,可断定反应达平衡
下列说法不正确的是( )
| A.硅单质是将太阳能转化为电能的常用材料 |
| B.氯气可用于自来水的杀菌消毒,说明氯气无毒 |
| C.光线透过树叶间的缝隙形成光柱与胶体的性质有关 |
| D.采用原煤脱硫技术,可减少燃煤时产生的SO2 |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)> c(OH-)>c(H+) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列实验装置设计正确、且能达到目的的是( )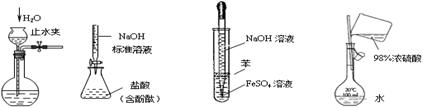
ⅠⅡⅢⅣ
| A.实验I: 检查装置的气密性 |
| B.实验II:测定未知盐酸的浓度 |
| C.实验III:制取并观察Fe(OH)2沉淀 |
| D.实验IV:配置一定的物质的量浓度的稀硫酸溶液 |
下列说法都正确的是( )
①江河入海口三角洲的形成通常与胶体的性质有关②建筑使用了大量钢材,钢材是合金③“钡餐”中使用的硫酸钡是弱电解质④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置⑤常用的消毒剂有氯气和二氧化硫,两者都有强氧化性 ⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
| A.①②③④ | B.①②④⑥ | C.①②⑤⑥ | D.③④⑤⑥ |
下列实验操作或事实与预期实验目的或所得结论一致的是( )
| 选项 |
实验操作或事实 |
实验目的或结论 |
| A |
取少量试液于试管中,加入用HNO3酸化的BaCl2溶液,产生白色沉淀 |
说明试液中一定含有SO42- |
| B |
分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一支试管中加入少量MnO2 |
研究催化剂对过氧化氢分解速率的影响 |
| C |
将NaHCO3与HCl两种溶液相互滴加 |
可以鉴别这两种溶液 |
| D |
C2H5Br与AgNO3溶液混合加热 |
检验C2H5Br中的溴元素 |