下列实验设计能完成或实验结论合理的是( )
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾—淀粉试纸检验,观察试纸颜色的变化 |
| B.用核磁共振氢谱图鉴别1-丙醇和2-丙醇 |
| C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试红上,待其变色后和标准比色卡比较 |
| D.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂一定不含Fe2O3 |
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )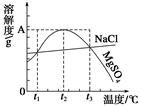
| A.只有在t1℃时,NaCl和MgSO4的溶解度才相等 |
| B.t1~t2℃,MgSO4的溶解度随温度升高而减小 |
| C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大 |
| D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是( )
①w=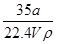 ×100%
×100%
②c=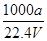
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
| A.①④ | B.②③ | C.①③ | D.②④ |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
| A.0.4 mol·L-1 | B.0.3 mol·L-1 |
| C.0.2 mol·L-1 | D.0.1 mol·L-1 |
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为( )
| A.a=b | B.a=2b |
| C.2a=b | D.a=5b |
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为( )
| A.1 mol·L-1 | B.1.5 mol·L-1 |
| C.2 mol·L-1 | D.2.5 mol·L-1 |