科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知、和的燃烧热分别为-285.8、-283.0和-726.5。请回答下列问题:
(1)用太阳能分解10水消耗的能量是;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3)在溶积为2的密闭容器中,由和合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:均大于300℃);

下列说法正确的是(填序号)
温度为时,从反应开始到平衡,生成甲醇的平均速率为
②该反应在时的平衡常数比时的小
③该反应为放热反应
④处于点的反应体系从变到,达到平衡时增大
(4)在温度时,将1和3充入一密闭恒容器中,充分反应达到平衡后,若转化率为,则容器内的压强与起始压强之比为;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为。理想状态下,该燃料电池消耗1甲醇所能产生的最大电能为702.1,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH )> c(SO )> c(SO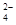 )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO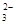 )+c(HCO )+c(HCO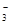 )+c(OH-) )+c(OH-) |
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO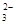 ) ) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中: |
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 2 mol·L-1 CaCl2溶液 |
| C.150 mL 2 mol·L-1 KCl溶液 | D.75 mL 1 mol·L-1 AlCl3溶液 |
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:
①蛋白质的变性 ②蛋白质的盐析 ③胶体的聚沉 ④盐类水解 ⑤焰色反应
⑥氧化还原反应
| A.①②③④ | B.①③④⑥ | C.②③④⑤ | D.②③⑤⑥ |
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3 NO
NO HNO3
HNO3
③NaCl(饱和) NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3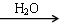 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
下列表示对应化学反应的离子方程式正确的是
| A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH- |
B.碳酸钠的水解:CO32-+ 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
| C.硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3·H2O===AlO+4NH4++2H2O |
| D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O |