下列说法不正确的是()
| A. |
已知冰的融化热为6.0,冰中氢键键能为20 。假设每摩尔冰中有2氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 |
| B. |
已知一定温度下,醋酸溶液的物质的量浓度为,电离度为, |
| C. |
实验测得环己烷(1)、环己烯(1)和苯(1)的标准燃烧热分别为-3916、-3747和-3265,可以证明在苯分子中不存在独立的碳碳双键。 |
| D. |
已知:。。 。则 |
有机物  的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基-4-乙基戊烷 | B.3,3-二甲基-4-乙基戊烷 |
| C.3, 3,4-三甲基已烷 | D.2,3,3-三甲基已烷 |
某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.升高温度时,正反应速率加快、逆反应速率减慢 |
| B.若x=l,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x=2,容器体积保持不变,新平衡下F的平衡浓度大于0.5a mol·L-1 |
| D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol |
短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为19。X的阳离子比阴离子少一层电子,Y与Z、W位于相邻周期,Y、Z的氧化物排放到空气中会形成酸雨。下列说法正确的是
| A.四种元素中,元素Z的非金属性最强 |
| B.X的单质是一种清洁能源 |
| C.只由四种元素中的三种元素不可能形成离子化合物 |
| D.YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
下列溶液中有关物质的量浓度关系正确的是
| A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c (Na+)>c (CH3COO-)>c(H+)>c(OH-) |
| B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中: c(Na+) = c(SO42-) >c(NH4+) >c(H+) >c(OH-) |
| C.NaHCO3溶液中:c(OH-)- c(H+)=c(H2CO3) — c(CO32-) |
D.在浓度均为0.1 mol·L-1Na2CO3、NaHCO3、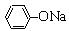 、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1 、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1 |
直接NaBH 4/H 2O 2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是 
A.电极B材料中包含MnO 2层,MnO 2可起催化作用
B.电池负极区的电极反应为:BH 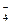 +8OH ――8e -=BO
+8OH ――8e -=BO  +6H 2O
+6H 2O
C.放电过程中,Na +从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH 2O 2溶液,理论
上流过电路中的电子为6N A个