某研究小组在实验室探究氨基甲酸铵()分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:

实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/ | 5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/ | 2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是。
| A. | B. | 密闭容器中总压强不变 | |
| C. | 密闭容器中混合气体的密度不变 | D. | 密闭容器中氨气的体积分数不变 |
②根据表中数据,列式计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量是(填"增加","减少"或"不变")。
④氨基甲酸铵分解反应的焓变O(填">"、"="或"<"),熵变O
(填">"、"="或"<")。
(2)已知:
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到时间的变化趋势如图所示。

⑤计算时,0-6氨基甲酸铵水解反应的平抑速率。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。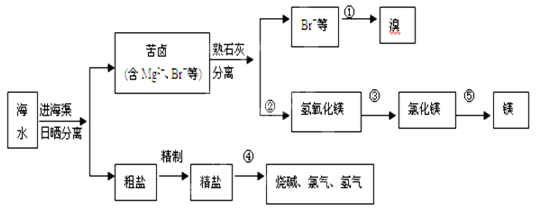
请回答下列问题:
1、①步主要反应的的离子方程式:。
溴的用途有很多,写出其中的一种。
2、分离出氢氧化镁的操作称为,第③步需要加入,写出该物质在水中的电离方程式: 。
3、将粗食盐中含有的Mg2+、Ca2+和SO42—等杂质除去,加入的试剂有(按加入顺序填入)。
4、④产物氢气在极生成,若电解食盐水时消耗NaCl的质量为234g,则在理论上最多可得氯气的体积为___ _升(标准状况)。
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程: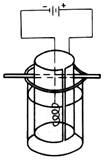
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________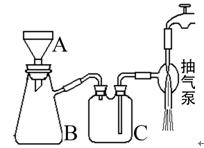
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是;
(2)资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是。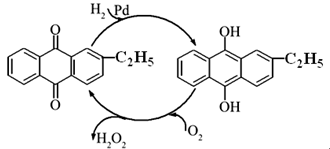
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
| 实验编号 |
T/℃ |
H2O2初始浓度/ mol·L-1 |
FeCl3初始浓度/ mol·L-1 |
| Ⅰ |
20 |
1.0 |
|
| Ⅱ |
50 |
1.0 |
0 |
| Ⅲ |
50 |
0.1 |
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为mol·L-1。
②三组实验中分解速率最快的是(填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
| 第一次 |
第二次 |
第三次 |
第四次 |
|
| 体积(mL) |
17.10 |
18.10 |
18.00 |
17.90 |
计算试样中过氧化氢的浓度为mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果(“偏高”或“偏低”或“不变”)。
(8分)某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。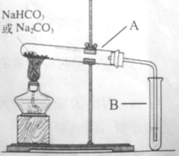
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用右图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是 (填“澄清的石灰水”或“NaOH溶液”)
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有 沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3 NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8、4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为 L(标准状况)
(8分)根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
| 实验操作 |
答案 |
实验现象 |
| (1)让一束光线通过Fe(OH)3胶体 |
A、呈蓝色 B、生成白色胶状沉淀 C、呈现光亮“通路” D、产生红褐色沉淀 |
|
| (2)向盛有FeCl3溶液的试管中加入NaOH溶液 |
||
| (3)向Al2(SO4)3溶液中滴加氨水 |
||
| (4)向土豆片上滴加碘水 |