下列有关化学用语表示正确的是
| A. |
的电子式:

|
| B. |
的结构示意图:

|
| C. |
质子数为53,中子数为78的碘原子:

|
| D. |
邻羟基苯甲酸的结构简式:

|
比较氯元素和硫元素的非金属性的相对强弱,下列方案中不能达到目的的是
| A.加热条件下,氯气和硫分别与铜反应,比较生成物中铜的化合价 |
| B.比较氯化氢和硫化氢的热稳定性 |
| C.往H2S溶液中通入氯气 |
| D.分别测定0.1mol/L氯化钠溶液和0.1mol/L硫化钠溶液的pH |
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应:
aTiO2+bCl2+cC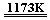 aTiCl4+cCO ……反应①
aTiCl4+cCO ……反应①
TiCl4+2Mg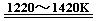 Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
关于反应①、②的分析不正确的是
① TiCl4在反应①中是还原产物,在反应②中是氧化剂;② C、Mg在反应中均为还原剂,被还原;③ 在反应①、②中Mg的还原性大于Ti,C的还原性大于TiCl4;④a=1,b=c=2;⑤ 每生成19.2gTi,反应①、②中共转移4.8mole-。
A.①②④ B.②③④ C.③④ D.②⑤
某无色溶液含有①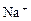 、②
、②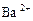 、③
、③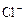 、④
、④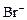 、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
、⑤SO32-、⑥SO4 2-离子中的若干种,依次进行下列实验。且每步所加试剂均过量,观察到的现象如下:
步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加足量氯水,再加入CCl4振荡,静置 |
CCl4 层呈橙色 |
| (3) |
向所得水溶液中加入足量Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
| A.肯定含有的离子是③④⑥ | B.肯定含有的离子是①④⑤ |
C.不能确定的 离子是①③⑤ 离子是①③⑤ |
D.肯定没有的离子是②③⑤ |
下列说法正确的是:
| A.已知:熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐 |
| B.单质熔点97.81℃,是热和电的良导体,该晶体最可能是分子晶体 |
| C.分子晶体溶于水时,分子中的化学键可能被破坏 |
| D.BaSO4、CaCO3、Fe(OH)3虽然不溶于水,但是它们均属于强电解质 |
常温下,海水在浓缩过程中析出盐的种类和质量(表中为每升海水析出的各种盐的克数。单位g/L)如下:
| 海水密度 (g/mL) |
CaSO4 |
NaCl |
MgCl2 |
MgSO4 |
NaBr |
| 1.13 |
0.56 |
||||
| 1.20 |
0.91 |
||||
| 1.21 |
0.05 |
3.26 |
0.04 |
0.008 |
|
| 1.22 |
0.015 |
9.65 |
0.01 |
0.04 |
|
| 1.26 |
0.01 |
2.64 |
0.02 |
0.02 |
0.04 |
| 1.31 |
1.40 |
0.54 |
0.03 |
0.06 |
海水从密度为1.21 g/mL浓缩到密度为1.22g/mL时发生的变化是:
A.各种盐的溶解度增大 B.海水中水的质量分数减小
C.析出的粗盐中 NaCl的质量分数增大 D.海水中Br-浓度不变