已知乙烯能发生以下转化: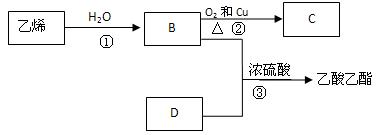
(1)乙烯的结构简式为:
(2)写出反应的化学方程式
① 反应类型:
② 反应类型:
③ 反应类型:
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素。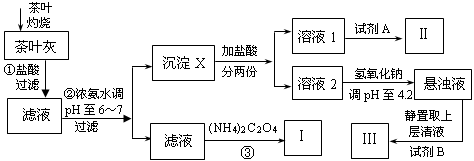
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 |
Al(OH)3 |
Fe(OH)3 |
|
| pH |
≥13 |
≥5.2 |
≥4.1 |
(1)步骤①中加入盐酸的作用是。
(2)步骤②中调节pH至6~7的目的是。
(3)沉淀X所含主要物质的化学式为。
(4)写出步骤③中发生反应的离子方程式:。
(5)试剂A为;试剂B为铝试剂,加入该试剂后的实验现象是。
黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式。K4[Fe(CN)6] 中Fe2+与CN-之间的作用力是。
(2)CN-中碳原子的杂化方式为;1molCN-中含有π键的数目为。
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为。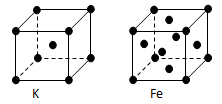
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为。
(12分) 钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图。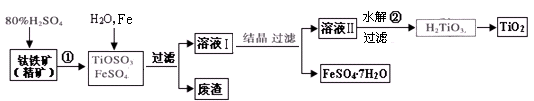
(1)钛铁矿与硫酸发生反应①的化学方程式为;在TiOSO4和FeSO4溶液中加入Fe的目的是。
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为;可回收利用的物质是。
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是。
斑螯素能抑制肝癌的发展,去掉斑螯素中的两个甲基制得的化合物——去甲基斑螯素仍具有相应的疗效,其合成路线如下:
已知:① 2HCHO+NaOH→ CH3OH+HCOONa
②  (Diels-Alder 反应)
(Diels-Alder 反应)
③当每个1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物: CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2。
请回答下列问题:
(1)物质A中含有的含氧官能团名称分别为;第①步反应中还生成另一产物,此产物的结构简式为。
(2)写出H的结构简式;第⑤步反应的反应类型是。
(3)去甲基斑螯素与X互为同分异构体。X能与FeCl3溶液发生显色反应,能与Na2CO3溶液反应生成气体,且其核磁共振氢谱有4个吸收峰。写出满足上述条件的X的一种结构简式。
(4)结合题中有关信息,写出由 制备丁烯二酸酐
制备丁烯二酸酐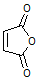 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
。
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: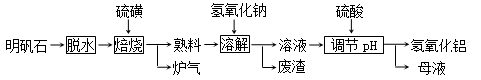
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为。
2Al 2O3+9SO2,其中氧化剂为。
(2)“溶解”时反应的离子方程式为。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是。