在一定温度下,4L密闭容器内存在反应 ,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
,其中气体M、气体N的物质的量随时间变化的曲线如图所示: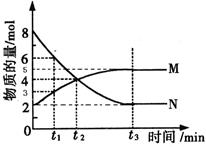
(1)比较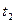 时刻,正逆反应速率大小V正 V逆。
时刻,正逆反应速率大小V正 V逆。
(2)若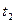 =2min,计算反应开始至
=2min,计算反应开始至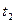 时刻,M的平均化学反应速率为:_____________________________。
时刻,M的平均化学反应速率为:_____________________________。
(3)t1与t2相比,反应速率__________较慢,其原因是__________________;已知该反应是放热反应,则N的能量___________M的能量(填“大于”、“小于”、“等于”)镁条和盐酸的总能量。
16O中的16表示的含义是()
| A.氧元素的相对原子质量 |
| B.氧元素的一种同位素的近似相对原子质量 |
| C.氧元素的近似相对原子质量 |
| D.氧元素的一种同位素的质量数 |
与元素的化学性质关系最密切的是( )。
| A.质子数 | B.中子数 | C.核电荷数 | D.最外层电子数 |
下列叙述中,正确的是()
| A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.两原子,如果核外电子排布相同,则一定属于同种元素 |
| D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
下列说法中不正确的是( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
| A.②④⑤⑥ | B.①②④⑤ | C.①②⑤⑥ | D.③④⑤⑥ |
对相同状况下的12C18O和14N2两种气体,下列说法正确的是()
| A.若质量相等,则质子数相等 | B.若原子数相等,则中子数相等 |
| C.若分子数相等,则体积相等 | D.若体积相等,则密度相等 |