短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是 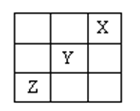
| A.X原子最外层电子数最多 |
| B.Y的非金属性比X的非金属性强 |
| C.Z的最高价氧化物的水化物是强碱 |
| D.Z的原子半径大于Y的原子半径 |
关于元素周期表的说法正确的是( )。
| A.元素周期表有8个主族 |
| B.ⅠA族的元素都是金属元素 |
| C.元素周期表有7个周期 |
| D.短周期是指第一、二周期 |
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )。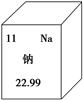
| A.该元素的名称是钠 |
| B.该元素的原子序数为11 |
| C.该元素的地壳中的含量为22.99% |
| D.该元素的元素符号为Na |
俄罗斯科学家用一种钙原子轰击含95个质子的镅原子,成功合成4个第115号元素的原子,这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )。
| A.115号元素在第六周期 |
| B.113号元素在第七周期ⅢA族 |
| C.115号和113号元素都是非金属元素 |
| D.镅元素和115号元素不在同一周期 |
在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的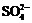 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为()
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为()
A.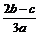 |
B.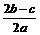 |
C.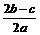 |
D.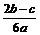 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是()
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =Kw/(1x10-9)mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)