有六种微粒,它们分别是: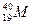 、
、 、
、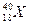 、
、 +、
+、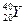 2+、
2+、 -,它们所属元素的种类为
-,它们所属元素的种类为
| A.3种 | B.4种 | C.5种 | D.6种 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g),△H=-92.6 kJ·mol-1
2XY3(g),△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
下列各表述与示意图一致的是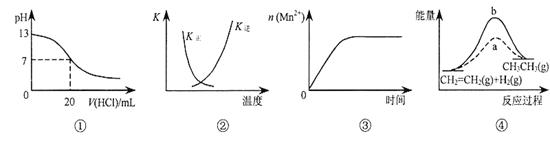
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |
下列事实不能用勒夏特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)  K(g)+NaCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
| A.②⑥ | B.①②③ | C.②⑤⑥ | D.①③④⑤ |
用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为
| A.1mol·L-1 | B.2 mol·L-1 |
| C.2.5 mol·L-1 | D.3 mol·L-1 |