在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ )中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
 xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是。
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是。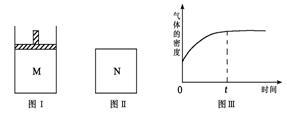
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
H++A2-。关于下列四种溶液的说法正确的是
①0.01mol/L的H2A溶液;②0.01mol/L的NaHA溶液;③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合;④0 .02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合;
.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合;
A.四种溶液中c(HA-)浓度大小:③>②>①>④
B.溶液①中一定不存在OH-
C.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
关于下列图示的说法中正确的是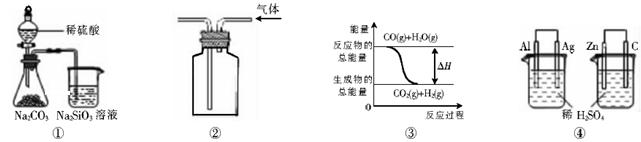
| A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0 CO2(g)+H2(g)的△H大于0 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
下列溶液中有关物质的量浓度关系和计算不正确的是
| A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)<c(CH3COONa) |
B.已知25°C时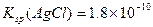 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到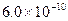 mol·L-1 mol·L-1 |
| C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 |
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有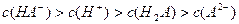 |
下列离子方程式正确的
A.往碳酸氢钙溶液中滴入少量氢氧化钠溶液:OH-+HCO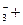 Ca2+ Ca2+ =CaCO3↓+H2O =CaCO3↓+H2O |
| B.将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+====Cu+2Na+ |
C.NaHCO3溶液显碱性:HCO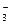 +H2O +H2O OH- +CO OH- +CO |
D.氯气溶解于水:Cl2+H2O 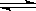 2H++Cl-+ClO- 2H++Cl-+ClO- |