氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 | B.24.23%表示35Cl的丰度 |
| C.35. 453表示氯元素的相对原子质量 | D.36.966表示37Cl的质量数 |
恒温条件下,对于可逆反应A(g)+ B(g)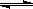 C(g)+ D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是
C(g)+ D(g),加入起始浓度相近的A和B,在达到平衡的过程中可能有三种情况,如下图所示。下列判断中正确的是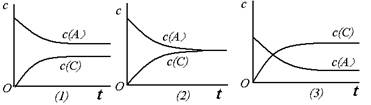
| A.⑴的K<1 | B.⑵的K≈1 | C.⑶的K>1 | D.以上三种可能全对 |
反应3A(g)+B(g)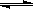 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v (A)="0.15" mol·L-1·s-1B.v (B)="0.3" mol·L-1·s-1
C.v (C)="0.5" mol·L-1·s-1D.v(D)="0.4" mol·L-1·s-1
在一定温度下,反应A2(g)+B2(g)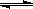 2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)
2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)
| A.单位时间生成NA的A2同时生成NA的AB |
| B.容器内的总压不随时间变化 |
| C.单位时间生成2NA的AB同时生成NA的B2 |
| D.单位时间生成NA的A2同时生成NA的B2 |
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示, 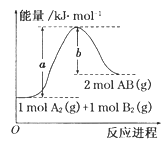
判断下列叙述中正确的是
| A.每生成2分子AB吸收bkJ热量 |
| B.该反应热△H=+(a-b)kJ·mol-1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1molA—A和1molB—B键,放出a kJ能量 |
某反应A + B =" C" + D 在低温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
| A.△H <0△S >0 | B.△H >0△S >0 |
| C.△H <0△S <0 | D.△H >0△S <0 |