多羟基连在同一个碳原子上易自动失水生成醛或酮
(1)根据上述原理,请写出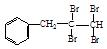 与NaOH的水溶液共热的化学方程式为: ;
与NaOH的水溶液共热的化学方程式为: ;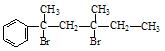 与NaOH的醇溶液共热可以生成 种稳定的二烯烃。
与NaOH的醇溶液共热可以生成 种稳定的二烯烃。
(2)醛酮在水中可生成水合物: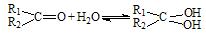 ;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若
;这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若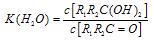 为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
| 化合物 |
  |
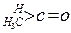 |
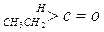 |
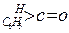 |
| K(H2O) |
2×103 |
1.3 |
0.71 |
8.3×10-3 |
| 化合物 |
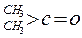 |
 |
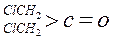 |
 |
| K(H2O) |
2×10-3 |
2.9 |
10 |
很大 |
根据以上表中数据分析,请总结出两条结论:
① 。
② 。
(3)工业上生产苯甲醛 有以下两种方法:
有以下两种方法:
与方法①相比,方法②的优点是 ,
缺点是 。
(4)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为 ;
反应②的反应类型属于 。
(5)由对苯二甲醛的氧化产物“对苯二甲酸”与“乙二醇”缩聚,生成的聚酯纤维(涤纶)
的结构简式为 。
用2.4mol/L的H2SO4溶液配制100mL浓度为0.2 mol/L的稀H2SO4,回答下列问题:
(1)需要量取2.4 mol/L的H2SO4溶液的体积是mL。
(2)配制过程有下列几步操作:
A 用量筒量取所需H2SO4溶液的体积,注入盛有适量水的烧杯中,用玻璃棒搅拌,使其混合均匀;
B 将蒸馏水加入容量瓶至液面接近刻度线1cm~2cm处;
C 向烧杯中加入约20mL蒸馏水;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也转移到容量瓶中;
E.用①加水至刻度线;
F.待烧杯中溶液冷却后,沿玻璃棒转移到②;
G.盖好瓶塞,反复颠倒摇匀。
以上各步骤操作的先后顺序是③(填字母)
(3)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48 g。则该溶液浓度
0.2 mol/L(填“大于”“等于”或“小于”)造成此误差的操作可能是
A 定容时俯视容量瓶 B 用量筒取2.4mol/L H2SO4溶液时俯视读数
C 使用容量瓶前未干燥 D.使用的烧杯和玻璃棒未洗涤彻底
E.定容时将蒸馏水洒在容量瓶外面
(1)下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
①相连的两种物质都是电解质的是(填分类标准代号,下同)都是氧化物的是。
②图中相连的两种物质能够相互反应的是,所属基本反应类型的是反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子
方程式为。
④用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物
质的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为,要证明该分散
系的实验的方法是。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中,使用分类的方法
处理问题可以做到举一反三,还可以做到由此及彼的效果。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可得出SO3
与NaOH反应的方程式。
②NaHCO3、NaHSO3、NaHS都属于非强酸形成的酸式盐,由NaHCO3+HCl=NaCl+H2O+CO2↑、
NaHCO3+NaOH=Na2CO3+H2O,完成NaHS分别与HCl、NaOH反应的方程式为:
、。
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol;
(2)该气体所含原子总数为____________个;
(3)该气体在标准状况下的体积为____________L;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_____________;
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。
(1)Y在周期表中的位置是__________________;X的氢化物与P的氢化物接近时的现象是_________.。
(2)W与P可形成一种个数比为1:2的化合物的电子式是___________________________。
(3)Y与P形成的化合物溶液显___性;用离子方程式表示显示这种性质的原因是_________________。
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是__________________;
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但是在潮湿的环境中能够与水发生反应生成无色气体,遇到空气变为红棕色。写出此三氟化物与水反应的化学方程式_________________;若0.6mol的X的三氟化物完全与水反应,则转移的电子总数约是____________个。
氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。(1)已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于区,其最高价应为;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了原理;
③B元素的第一电离能大于Al,原因是;
( 2 )氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由
。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为。