已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示:
⑴写出C的结构简式: .
⑵A中官能团名称是: .
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式:
, , .
⑷写出D→E化学反应方程式: .
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为。
(4)右图为绿色电源“二甲醚燃料电池”的工作原理示意图。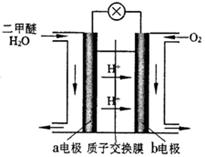
该电池工作时,H+向极移动(填“正”或“负”);a电极的电极反应式为。
某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)物质B可直接用作氮肥,则B的化学式是。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式。
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)△H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g)△H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g)△H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式。
一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。
①300℃时残留固体的成分为,900℃时残留固体的成分为。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)