 某探究
某探究 小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L 盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属
盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属 用量均为9. 0g。
用量均为9. 0g。
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比 较连续的气泡 较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 。
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出 你的假设(写出2种可能): 。
你的假设(写出2种可能): 。
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃)。请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50. 0mL、铝为9. 0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L-1 |
| 1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 |
① |
25˚ C C |
铝 |
4. 0 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
下图所示为苯和溴的取代反应的实验改进后的装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就会发生反应。该反应中铁屑粉的作用是___________________________,写出A中发生反应的化学方程式(有机物 写结构简式)________________________________________。
写结构简式)________________________________________。
(2)试管C中苯的作用是。反应开始后,观察D和E两支试管,看到的现象为___________________________________________。
(3)F中发生反应的离子方程式是___________________。
(4)在上述整套装置中,采取了防倒吸措施的装置是________________(填字母代号)。
(5)实验室得到粗溴苯后,要用如下操作精制:①蒸馏②水洗③用干燥剂干燥④10% NaOH溶液洗⑤水洗正 确的操作顺序是(填写序号)
确的操作顺序是(填写序号)
| A.①②③④⑤ | B.②④⑤③① |
| C.④②③①⑤ | D.②④①⑤③ |
.已知室温下乙醛的沸点为20.8℃,且与水互溶。用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如下图所示,请回答下列问题;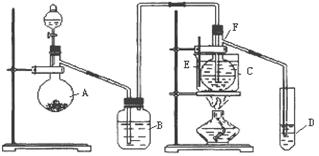
(1)实验开始时,仪器A中盛放电石,B中应装,其作用是。
(2)仪器D中盛放水,其作用是。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称。将HgO加放到F中的操作方法是。
(4)装置图中,加热F的方法叫,所选用温度计F的量程表示正确的是
(填代号)。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.0℃~360℃ |
(5)检验乙醛已制出的操作及现象是
。
下列操作或叙述不正确的是(填序号)。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 |
| C.乙醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.苯酚不小心沾在手上,立即用NaOH溶液清洗
H.某些蛋白质与浓硝酸作用显黄色
(10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3 2
2 SO2↑+ O2↑
SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。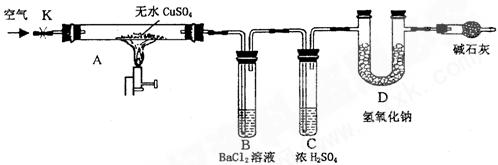
实验步骤:
①称量反应前D 管的质量。
管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。
。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
(1)圆底烧瓶中发生反应的化学方程式为。
(2)A 中m 管的作用是。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是。
(4)E中若装有FeCl2 溶液,反应的离子方程式为;E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,长郡中学高二化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;
实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是。