下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) ="=" 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
下列物质中可以使酸性高锰酸钾溶液褪色,但不能使溴水褪色的是( )。
| A.甲烷 | B.乙烯 | C.乙醇 | D.苯 |
A、B、C三种醇同足量的金属钠完全反应,相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则三种醇分子里的羟基数之比为( )。
A.3∶2∶1 B.2∶6∶2
C.3∶1∶2 D.2∶1∶3
下列选项中能说明乙醇(酒精)作为燃料的优点是( )。
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种再生能源
④燃烧时放出大量热
| A.①②③ | B.①②④ |
| C.①③④ | D.②③④ |
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )。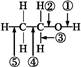
| A.和金属钠反应时①键断裂 |
| B.在铜催化及加热条件下与O2反应时断裂①键和③键 |
| C.在铜催化及加热条件下与O2反应时断裂①键和⑤键 |
| D.在空气中完全燃烧时断裂①②③④⑤键 |
下列物质最难电离出H+的是( )。
| A.CH3COOH | B.C2H5OH | C.H2O | D.H2CO3 |