合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应是N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应是N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。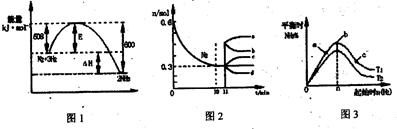
下列说法正确的是
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
.三组混合液:①植物油和水;②乙醇和水;③氯化钠和单质碘的混合水溶液,分离它们的正确方法依次是()
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
分类方法在化学学科的发展中起到了重要作用。下列分类标准合理的是()
A根据纯净物的元素组成,将纯净物分为单质和化合物.
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、置换、复分解”四类
下列说法正确的是()
| A.NaOH的摩尔质量为40 g |
| B.1 mol O2的质量与它的相对分子质量相等 |
C.1 mol OH-的质量为17 g·mol-1 |
| D.氦气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量 |
设NA为阿伏加德罗常数,下列对于0.3 mol/L硫酸钾溶液的说法不正确的是()
| A.1 L溶液中含有0. 6 NA个钾离子 |
| B.1 L溶液中含有钾离子和硫酸根离子总数为0.9 NA |
| C.2 L溶液中钾离子浓度为1.2 mol/L |
| D.2 L溶液中含有硫酸根离子0.6 NA个 |
电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+。下列物质在水溶液中的电离方程式错误的是( )
| A.CuSO4===Cu2++SO | B.NaHSO4===Na++HSO |
| C.NaOH===Na++OH- | D.HCl+H2O===H3O++Cl- |