下列物质性质的变化规律,与共价键的键能大小有关的是
| A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.金刚石的硬度、熔点、沸点都高于晶体硅 |
| D.醋酸易溶于水,而乙烷易溶于四氯化碳 |
对于可逆反应:mA(g)+nB(g) xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是
xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是
| A.ΔH>0,m+n>x+y | B.ΔH<0,m+n>x+y |
| C.ΔH<0,m+n>x | D.ΔH>0,m+n<x |
下图有关电化学的示意图正确的是
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
| A.某温度下,测得溶液的pH < 7 |
| B.溶液中c(Na+)=c(A2-) |
| C.溶液中存在Na+、HA-、A2-、H2A 多种微粒 |
| D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 |
常温下,下列各组离子在有一定关限定条件下的溶液中一定能大量共存的是
| A.由水电离产生的c(H+)=10-12 mol·L一1的溶液中:K+、Na+、Fe2+、NO3- |
B.常温下,pH=7的溶液中: Al3+、Cl-、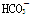 、SO42- 、SO42- |
C.常温下, =1×10-12的溶液:K+、Cu2+、S2-、Cl- =1×10-12的溶液:K+、Cu2+、S2-、Cl- |
| D.pH=13的溶液中:K+、Ba2+ 、Cl-、OH- |
在体积为1L的密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g)。达到平衡后,若采用下列措施一段时间后,能增大逆反应速率的是
2SO3(g)。达到平衡后,若采用下列措施一段时间后,能增大逆反应速率的是
| A.体积不变,通入NO |
| B.增大容器容积 |
| C.体积不变,通入大量O2 |
| D.降低体系温度 |