银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为:Ag2O + Zn + H2O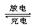 2Ag + Zn(OH)2,则下列说法正确的是
2Ag + Zn(OH)2,则下列说法正确的是
| A.放电时Ag2O参与反应的电极为负极 |
B.放电时 负极附近的pH逐渐减小 负极附近的pH逐渐减小 |
| C.充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移1 mol电子 |
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是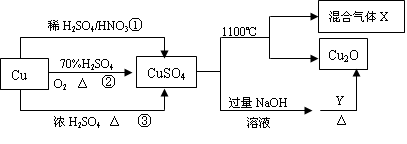
| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.若Y是有机物,则Y只可属醛类 |
| C.1molCuSO4在1100℃所得混合气体X用足量硝酸钡溶液吸收可得沉淀233g |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
下列说法符合事实的是
| A.常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气 |
| B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl—、CrO42—浓度相同的溶液中滴加几滴稀AgNO3溶液时,则先生成AgCl沉淀 |
| C.电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度 |
| D.在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失 |
在25°C,101kPa下,由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与2.24L氧气(标态)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为
| A.等于6.72g | B.小于6.72g | C.大于6.72g | D.无法计算 |
用下列实验装置进行相应的实验,能达到实验目的的是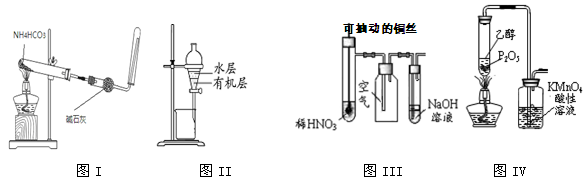
| A.图I所示装置用于制取少量的氨气 |
| B.图II所示装置用于提取I2的CCl4溶液中的I2 |
| C.图III所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| D.图IV所示装置可制取乙烯并验证其易被氧化 |
下列有关说法正确的是
| A.Hg(l) + H2SO4(aq) = HgSO4(aq) + H2(g)常温下不能自发进行,说明△H<0 |
| B.用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 |
| C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 |
| D.25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |