随着能源 问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: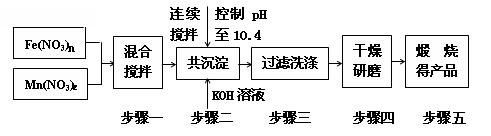
(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是_________________________________________;
步骤三中洗涤干净的标准是________________________________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 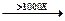 MnFe2O4-x +
MnFe2O4-x + 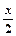 O2↑MnFe2O4-x + xH2O→MnFe2O4 + xH2↑,
O2↑MnFe2O4-x + xH2O→MnFe2O4 + xH2↑,
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
②该化学循环制氢的优点有(答两点即可)
_____________________________________________________________________。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是_________。
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
| 序号 |
0 |
10 |
20 |
30 |
40 |
50 |
|
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: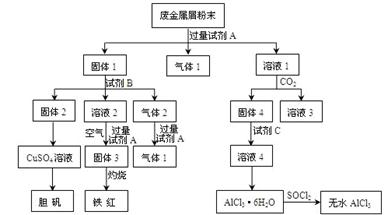
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是。
(2)溶液2中含有的金属阳离子是;气体2的成分是。
(3)溶液2转化为固体3的反应的离子方程式是。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是。
右图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
已知: 2Na2O2 + 2CO2→ 2Na2CO3 + O2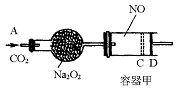
已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必0.01(填大于、小于、等于),其理由是。
若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下: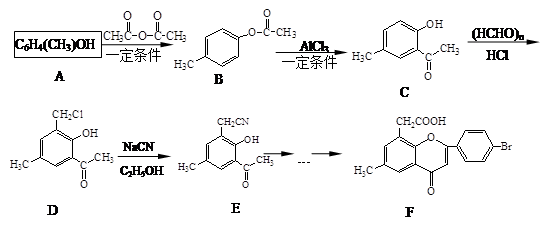
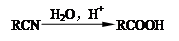
已知:RCN在酸性条件下发生水解反应:
写出A转化为B的化学方程式_______________。
F分子中有3个含氧官能团,名称分别为醚键、___________和_____________。
E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为______________________。
写出符合下列条件的D的两种同分异构体的结构简式___________________。
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物含有酚羟基,另一种水解产物含有醛基。
对羟基苯乙酸乙酯(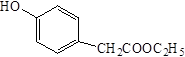 )是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。
)是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。
化合物Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ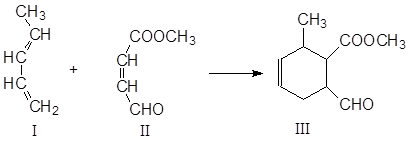
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下: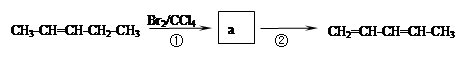
a的结构简式是______________________,②步的反应类型是_______________。
化合物I的一种同分异构体是天然橡胶的单体,用系统命名法命名该单体___________。
化合物Ⅰ与II反应还可能得到III的一种同分异构体,该物质的结构简式为__________。
欲检验化合物Ⅲ中的碳碳双键,正确的试剂是_______________________。