甲醛,分子式CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是
| A.C原子采取sp3杂化,O原子采取sp杂化 |
| B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 |
| C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键 |
| D.甲醛分子为非极性分子 |
a,b,c,d,e是同周期的五种元素,比较a和b的最高价氧化物对应水化物的碱性是b>a;比较c和d的气态氢化物的还原性是d>c;五种元素的原子得到或失去电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是
| A.baedc | B.abdce | C.ebadc | D.cdeab |
关于下图所示各装置的叙述中,正确的是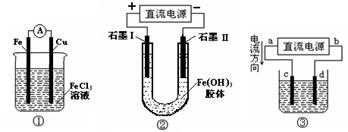
| A.装置①是原电池,总反应是:Cu + 2Fe3+ = Cu2+ + 2Fe2+ |
| B.装置①中,铁做负极,电极反应式为:Fe3+ + e- = Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法正确的是
| A.溶液的pH增大,有O2放出 |
| B.溶液的pH不变,有O2放出 |
| C.溶液中的c(Na+)增大,有O2放出 |
| D.溶液中的c(Na+)减小,有O2放出 |
已知①2C(s)+O2(g)====2CO(g);ΔH=-221.0 kJ·mol-1
②2H2(g)+O2(g)====2H2O(g);ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+ H2O (g)====CO(g)+H2(g);ΔH为
| A.262.6 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.+131.3 kJ·mol-1 | D.-352.3 kJ·mol-1 |
密闭容器中进行如下反应: X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
| A.Y2为 0.35 mol/L | B.Y2为 0.2 mol/L |
| C.X2为 0.2 mol/L | D.Z 为 0.4 mol/L |