CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去(已知Ksp Fe(OH)3=4.0×10-38,Ksp Cr(OH)3=6.0×10-31)。已知电解后的溶液中c(Fe3+)为4×10-14 mol·L-1,此时溶液的pH(室温下测得)和溶液中c(Cr3+)分别为
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
可用于干燥NH3的试剂是
| A.无水CACl2 | B.浓H2SO4 | C.P2O5 | D.碱石灰 |
可用化学方法鉴别NO2和Br2蒸气的是
| A.淀粉-KI溶液 | B.AgNO3溶液 | C.Cl2 | D.NAOH溶液 |
实验室可用下图装置(启普发生器)制取氢气。欲使得到氢气的速率加快,下列措施可行的是: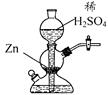
| A.将稀硫酸改用浓硫酸 |
| B.向稀硫酸中加入少量浓H2SO4 |
| C.向稀硫酸中加入Cu(NO3)2溶液 |
| D.给装置中发生反应的部分加热 |
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) 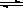 2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
| A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 |
| B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高 |
| C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 |
| D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
下列物质中,导电性由大到小排列正确的是
①500mL 0.1mol/L 的盐酸溶液;②100mL 0.1mol/L 的硫酸溶液
③800mL 0.1mol/L 是醋酸溶液;④1L 0.1mol/L 的酒精溶液
| A.①②③④ | B.④①③② | C.②①③④ | D.①③②④ |