熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一 定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。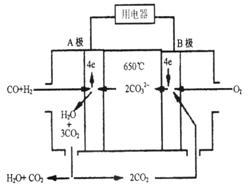
请回答下列问题:
(1)B极发生____(填“氧化”或“还原”)反应
(2)电池总反应为___________________________________________。
(3)以 此电源电
此电源电 解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶
解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶 液体积为1 L,溶液的pH约为 。
液体积为1 L,溶液的pH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
碘水(黄色) |
| 现象 |
褪色 |
||
| 体现SO2的性质 |
水溶液显酸性 |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液②蘸有淀粉KI溶液③蘸有石蕊溶液④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________
(10分) 铝是一种重要金属:
(1)生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与磁性氧化铁发生反应的化学方程式为 。该反应中氧化剂是 ,还原剂是 ,要得到1mol金属铁,需要铝的质量 g。(2) 铝与NaOH溶液反应的离子方程式为: 。在同温同压下,等质量铝投入足量盐酸和NaOH溶液中,产生气体的体积之比为 。
(8分)在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1) 切开的金属钠暴 露在空气中,最先观察到的现象是
露在空气中,最先观察到的现象是
,所发生反应的化学方程式是 。
。
(2) 将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:
①,②。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是(填编号)。
| A.有气体生成 |
| B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
(3) 在钠与水反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为。
(4) 根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是。
(6分)(1)0.5 mol H2O的质量为_______________,其中含有_______________个水分子,共有_______________个原子。
(2)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_______________;在相同温度和相同压强条件下,体积最大的是_______________,体积最小的是_______________。
(10分)已知:A、F为金属单质,D、E为 气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
(1)A的原子结构示意图为 _____________________,B的化学式为_______ __________。
__________。
(2)写出反应C+I→J的离子方程式:___________________________________________。
(3)写出E+F→I的化学反应方程式为___________________________,D在E中点燃时的现象为________________________________________________________。