(12分)A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3 :4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为: ________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:_________________________________________
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气 体的物质的量为________mol。
体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应,水的密度为1 g·cm-3),其溶液中溶质的质量分数为_______。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____g·mol-1。
已知X为FeO和CuO的混合物,取两份等质量的X样品进行如图18-3所示实验: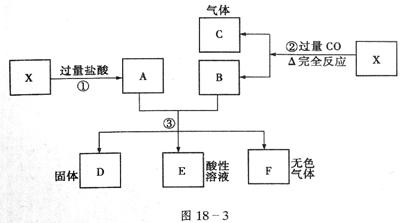
(1)写出第③步反应的离子方程式:__________________________
(2)实验中从第③步所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下的体积为5.6L。试计算取用的每份X中FeO和CuO的质量比。
反应3Fe(S)+4H 2O====Fe3O4(s)+4H2(g),在
2O====Fe3O4(s)+4H2(g),在 一可变的容积的密闭容器中进行,试回答:
一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减 小,以下相同)
小,以下相同)
②将容器的体积缩小一半,其正反应速率,逆反应速率 。
。
③保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
④保持压强不变,充入N2使容器的体积增大,其正反应速率,逆反应速率。
有两个起始体积相同的密闭容器A和B, A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比
为2 ∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在
400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
⑴ 达到平衡所需时间,A容器比B容器_______,两容器中SO2的转化率A比B______。
⑵ 达 到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动
到⑴所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡________移动 。
。
⑶ 达到⑴所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________,B容器中SO3的体积分数__________(填变大、变小、不变)。
22.反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题:
C(g) +D(g)过程中的能量变化如图所示,回答下列问题: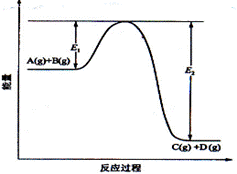
(1)该反应的反应物总能量________生成物的总能量(选填“ 小于”“大于”或“相等”)。
小于”“大于”或“相等”)。
(2)当反应达到平衡时,若升高温度,A的转化率_____(选填“增大”“减小”“不变”原因是____________
____________;若增大压强,则V正 V逆(选填“<”“>”“=”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1____,E2_____(填“增大”“减小”“不变”)。