氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
回答下列问题:
(1)p中盛装试剂的名称为。
(2)反应开始后,观察到的实验现象是:
①处:;
②处:;
③处:。
(3)写出④处反应的离子方式:。
已知A、B、C、D、E均为常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。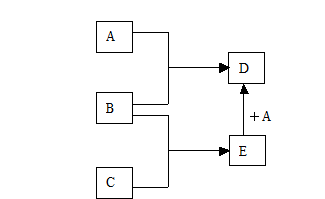
请回答:
(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为______,A和E在一定条件下反应生成D的化学方程式为
_____________。
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为不含氧元素的酸,且C的组成中含有与A相同的元素。则C的化学式为___________,A和E在一定条件下反应生成D的离子方程式_______。
如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。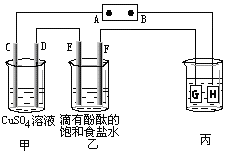
请回答:
(1)A极是电源的,甲装置观察到的现象是、
、。
(2)C极的电极反应式为。
(3)现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是溶液。
阅读下表中部分短周期主族元素的相关信息:
请回答:
| 元素代号 |
相关信息 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期的所用金属离子中,Y的离子半径最小 |
| Z |
Z与Y同周期,是所在周期中原子半径最小的元素 |
| T |
T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为,该化合物中所含的化学键有(填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
、。
已知强酸与强碱反应的中和热为—57.3KJ/mol,请写出硫酸溶液与氢氧化钠溶液反应的中和热的热化学方程式。