如图所示,两列简谐横波分别沿x轴正方向和负方向传播,两波源分别位于x=-0.2 m和x=1.2 m处,两列波的速度均为v=0.4 m/s,两波源的振幅均为A=2 cm。图示为t=0时刻两列波的图像(传播方向如图所示),此刻平衡位置处于x=0.2 m和x=0.8 m的P、Q两质点刚开始振动.质点M的平衡位置处于x=0.5 m处,关于各质点运动情况判断正确的是( )
| A.t=1 s时刻,质点M的位移为-4 cm |
| B.t=1 s时刻,质点M的位移为+4 cm |
| C.t=0.75 s时刻,质点P、Q都运动到M点质点不移动只上下移动 |
| D.质点P、Q的起振方向都沿y轴负方向 |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )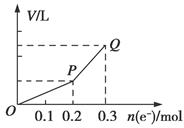
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
下列电化学实验装置正确的是( )
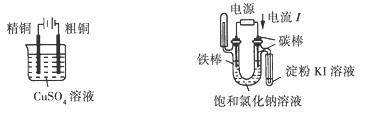 |
|
| A.电解精炼铜 |
B.验证电解饱和氯化钠溶液 (含酚酞)的产物 |
 |
|
| C.在铁制品上镀铜 |
D .构成原电池 |
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4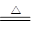 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为43 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示: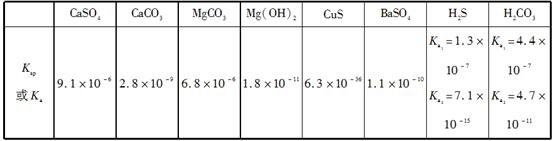
则下列说法不正确的是( )
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
| D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO3—+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )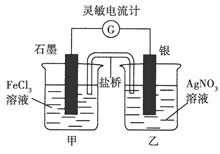
| A.在外电路中,电子从石墨电极流向银电极 |
| B.盐桥中的K+移向乙烧杯 |
| C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |