向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g) 2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)="0.2mol" L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
2SO3(g);△H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)="0.2mol" L-1,且SO2和O2的转化率相等。下列说法中,不正确的是( )
| A.2min时,c(SO2)="0.6mol" L-1 |
| B.用O2表示4min内的反应速率为0.1mol·(L·min)-1 |
| C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 |
| D.4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |
在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2.下列叙述错误的是()
| A.化学反应速率乙>甲 | B.平衡后O2浓度乙>甲 |
| C.SO2转化率乙>甲 | D.平衡后SO2的体积分数乙>甲 |
把0.6 mol X气体和0.4 mol Y气体混合于1L容器中使它们发生如下反应,3X(g)+Y(g) nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
| A.1 | B.2 | C.3 | D.4 |
下列热化学方程式或离子方程式中,正确的是:()
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H= -38.6kJ·mol-1 2NH3(g) △H= -38.6kJ·mol-1 |
| C.氯化镁溶液与氨水反应:Mg2++2OH-- =Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH--=2AlO2-+H2O |
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)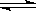 CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为()
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为()
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.5mol |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。
据图判断正确的是( )
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点KW的数值比c点KW的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |