根据中学化学教材所附元素周期表判断,下列叙述正确的是
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第三、四、五、六周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
下列操作过程中一定有氧化还原反应发生的是()



A B C D
氧化还原反应的实质是()
| A.得氧和失氧 | B.化合价的升降 | C.有无新物质生成 | D.电子的转移 |
下列关于热化学反应的描述中正确的是()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4Ca(OH)2反应的中和热为2×(-57.3)kJ/mol |
| D.CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程为 |
CO(g)+1/2O2(g)===CO2(g)△H=-283.0kJ/mol
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( ) 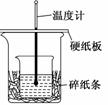
| A.如图条件下实验过程中没有热量损失 |
| B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯 |
已知25℃、101 kPa条件下:4Al(s)+3O2(g)===2Al2O3(s),ΔH=-2834.9 kJ/mol;
4Al(s)+2O3(g)===2Al2O3(s),ΔH=-3119.1 kJ/mol。由此得出的正确结论是 ( )
| A.等质量的O2比O3能量低,由O2变O3为放热反应 |
| B.等质量的O2比O3能量高,由O2变O3为吸热反应 |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.O2比O3稳定,由O2变O3为吸热反应 |