下列离子方程式中正确的是 ( )
| A.在硫酸氢钾溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO2-4====BaSO4↓+H2O |
| B.澄清石灰水与少量小苏打溶液混合:HCO-3+Ca2++OH-===CaCO3↓+H2O |
| C.少量金属钠加到冷水中:Na+2H2O===Na++2OH-+H2↑ |
| D.明矾水解:Al3++3H2O===Al(OH)3↓+3H+ |
下列实验能达到实验目的且符合安全要求的是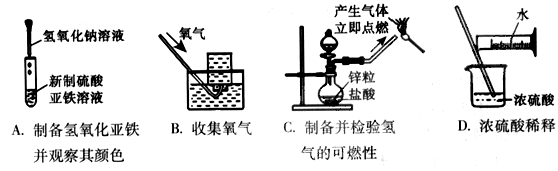

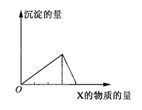
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是
| A |
B |
C |
D |
|
| X |
CO2 |
HCl |
NaOH |
AlCl3 |
| Y |
Ca(OH)2 |
NaAlO2 |
AlCl3 |
NaOH |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是
| A.p(Ne)>p(H2)>p(O2) | B.p(O2)> p(Ne)> p(H2) |
| C.p(H2)> p(O2)> p(Ne) | D.p(H2)> p(Ne)> p(O2) |
下列各组物质或概念之间,不符合右图所示关系的是
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |