(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。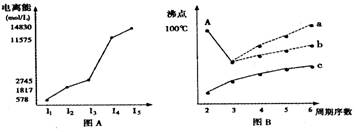
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可表达第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。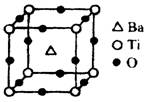
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液 ,均产生白色沉淀;
,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色 沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为_________________。
(2)A与溴的四氯化碳溶液反应的化学方程式为_____ ______________,反应类型是_________________。
(3)已知: 请写出A与稀、冷的KMnO4溶液
请写出A与稀、冷的KMnO4溶液
在碱性条件下反应生成的有机产物的结构简式:_________________________________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式:_____________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________________。
根据下面的反应路线及所给信息填空。
(1)A的结构简式是____________,B的结构简式是____________。
(2)反应④所用的试剂和条件是_______________________________________。
(3)反应②的化学方程式是___________________________________________,
反应⑥的化学方程式是___________________________________________。
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 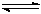 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是,2molN2参加反应转移电子数为。
(2) 达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
(共4分)合成尿素的反应是分作两步进行的:
① 2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l) △H =+28.49kJ/mol
CO(NH2)2(aq)+ H2O(l) △H =+28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。生产过程中n(NH3):n(CO2)的最佳配比为,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是。
(共8分)(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
(1) ①c电极的名称为________,d电极上的电极反应式为。
②如图2所示电解100mL 0.5mol·L-1CuSO4溶液。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_____(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______(填字母序号)。
a.CuO b.Cu(OH)2 c.CuCO3d.Cu2(OH)2CO3
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。