反应N2O4(g) 2NO2(g);△H=" +57" kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H=" +57" kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
下列离子方程式正确的是
| A.稀硫酸滴在铜片上: Cu + 2H+ ="=" Cu2+ + H2↑ |
| B.氧化镁与盐酸混合: MgO+ 2H+ ="=" Mg2+ + 2H2O |
| C.铜片插入硝酸银溶液中: Cu + Ag+ ="=" Cu2+ + Ag |
| D.大理石溶于醋酸的反应: CO32- + 2CH3COOH ==2CH3COO- +CO2↑+ H2O |
下列叙述中正确的是
| A.H2SO4的摩尔质量是98 |
| B.CO的摩尔质量为28 g/ mol |
| C.1 molO的质量是16g/ mol |
| D.将98gH2SO4溶解于500 mL水中,所得溶液中H2SO4的物质的量浓度为2 mol/L |
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是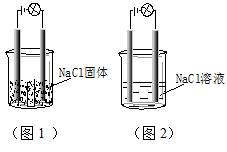
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
C.N aCl在水溶液中电离出了可以自由移动的离子 aCl在水溶液中电离出了可以自由移动的离子 |
| D.NaCl溶液中水电离出大量的离子 |
下列叙述中正确的是
| A.氧化还原反应中氧化剂得电子,化合价升高 |
| B.氧化还原反应中,一种物质被氧化,另一种物质必然被还原 |
| C.氧化还原反应的实质是电子的转移(得失或偏移) |
| D.物质所含元素化合价升高的反应是还原反应 |
下列实验方案可行的是
| A.用澄清石灰水检验CO2含有的CO |
| B.用经盐酸酸化的AgNO3溶液检验溶液中含有的Cl- |
| C.用蒸馏水鉴别无水硫酸铜、碳酸钙、氯化铵 |
| D.用溶解、过滤的方法分离 CaCl2 和NaCl固体混合物 |