下列各指定微粒的数目之比不是1∶1的是:
| A.Na2O2晶体中阴离子和阳离子 | B.NaHCO3晶体中的钠离子和碳酸氢根离子 |
C.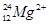 离子中的质子和中子 离子中的质子和中子 |
D.氯化铵溶液中的铵根离子和氯离子 |
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
| A.阴极 | B.阳极 | C.正极 | D.负极 |
锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如图,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应化学方程式为:LiCoO2 = Li1-xCoO2+xLi。关于该电池的推论错误的是
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-= xLi+
C.充电时,有电能转化为化学能
D.充电时,负极(C)上锂元素被氧化
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
| A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+ |
| B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+ |
| D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl- |
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
| A.CuS<Cu(OH)2<CuCO3 | B.CuCO3<Cu(OH)2<CuS |
| C.CuS<CuCO3<Cu(OH)2 | D.Cu(OH)2<CuCO3<CuS |