水作为还原剂的反应是:( )
| A.2Na + 2H2O=2NaOH + H2↑ | B.SO3 + H2O=H2SO4 |
| C.2F2 + 2H2O=4HF + O2↑ | D.2H2 + O2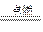 2H2O 2H2O |
可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
| A.氯化铁溶液、溴水 | B.碳酸钠溶液、溴水 |
| C.酸性高锰酸钾溶液、溴水 | D.酸性高锰酸钾溶液、氯化钠溶液 |
下列各组有机物均属于烃的衍生物且只用水就可以区分开的是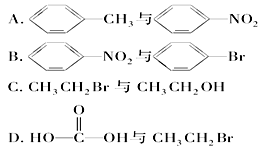
下列关于常见有机化合物的说法中,正确的是
| A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B.分子式为C5H12的有机物只有三种,它们互为同分异构体,性质完全相同 |
| C.甲烷、苯、乙醇、乙酸和乙酸乙酯都能发生氧化反应和取代反应 |
| D.糖类、油脂和蛋白质都是人体必需的营养物质,它们都是高分子化合物 |
下列说法不正确的是
①将SO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成 ②将盐酸、KSCN
溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 ③向某溶液中滴入盐酸酸
化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42— ④将两小块质量相等
的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等⑤使用明矾可以对水进行消毒、杀菌
| A.只有② | B.①②③⑤ | C.①③④ | D.①②③④ |
除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是
| A.通入二氧化碳气体 | B.加入氢氧化钡溶液 |
| C.加入澄清石灰水 | D.加入稀盐酸 |