原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。
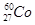 的衰变方程式为
的衰变方程式为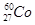 =
=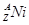 +
+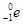 +Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
+Ve,其中Ve是反中微子,它的电荷为零,静止质量可以为零。
(1)下列关于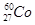 的叙述中,错误的是________(填序号)。
的叙述中,错误的是________(填序号)。
A.质子数是27B.电子数是27
C.质量数是27D.中子数是60
(2)在上述衰变方程中,衰变产物Ni的质量数A为______,核电荷数Z为________。
(3)元素的化学性质主要取决于________(填序号)。
A.最外层电子数B.核内中子数
C.核内质子数D.质量数不同
(4)不同种元素的本质区别是________(填序号)。
A.质子数不同B.中子数不同
C.电子数不同 D.质量数不同
华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。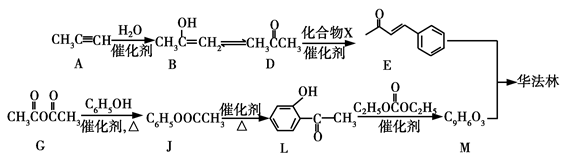
(1)A的名称为________,A→B的反应类型为________。
(2)D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为________。
(3)G→J为取代反应,其另一产物分子中的官能团是________。
(4)L的同分异构体Q是芳香酸,Q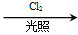 R(C8H7O2Cl)
R(C8H7O2Cl)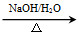 S
S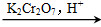 T,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为________。
T,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为________。
(5)题图中,能缩合成体型高分子化合物的酚类单体是________。
(6)已知:L→M的原理为:
①
②
则M的结构简式为_________________
已知:

水杨酸E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为________;结构分析显示A只有一个甲基,A的名称为________。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为__________________________。
(3)C有________种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:________。
(4)第③步的反应类型为________;D所含官能团的名称为________。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:__________________________。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团。
(6)第④步的反应条件为________;写出E的结构简式:______________。
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):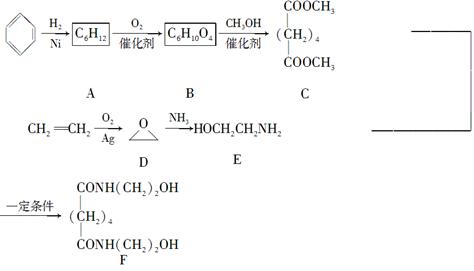
(1)B的结构简式是________;E中含有的官能团名称是________。
(2)由C和E合成F的化学方程式是________。
(3)同时满足下列条件的苯的同分异构体的结构简式是________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰
③不存在甲基
(4)乙烯在实验室可由________(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是________。
a.A属于饱和烃
b.D与乙醛的分子式相同
c.E不能与盐酸反应
d.F可以发生酯化反应
下列是利用烃C3H6合成有机高分子E和烃C6H14的流程图。请回答以下问题: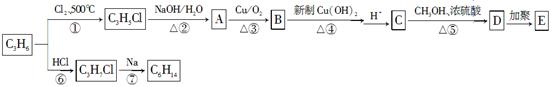
(1)①~⑥中属于取代反应的有________。
(2)C6H14的核磁共振氢谱只有两种峰,则C6H14的结构简式为________________;写出E的结构简式:__________________。
(3)写出B与新Cu(OH)2反应的化学方程式:________________。
(4)D的同分异构体很多,符合下列条件的同分异构体有________种,其中氢原子核磁共振氢谱谱峰最少的结构简式为________。
①含碳碳双键 ②能水解 ③能发生银镜反应
(5)根据你所学知识和上图中相关信息,以乙醇为主要原料通过三步可能合成环己烷(无机试剂任选),写出第一步和第三步化学反应的化学方程式(有机物质写结构简式):________、________。