为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是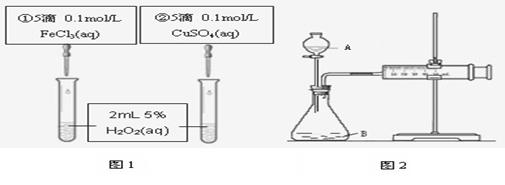
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
水蒸气通过炽热的炭层时,发生的反应为C+H2O CO+H2,该反应属于
CO+H2,该反应属于
| A.化合反应 | B.置换反应 | C.分解反应 | D.复分解反应 |
下列物质属于纯净物的是
| A.医用酒精 | B.干冰 | C.清新空气 | D.加碘食盐 |
物质不需要通过化学变化就能体现的性质是
| A.可燃性 | B.不稳定性 | C.挥发性 | D.还原性 |
自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式。火炬的可燃物是丁烷 (化学式为 C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见。下列关于丁烷的叙述不正确的是
| A.丁烷由碳、氢两种元素组成 |
| B.丁烷由 4 个碳原子和 10 个氢原子构成 |
| C.丁烷中碳、氢元素的质量比是24∶ 5 |
| D.丁烷分子由碳原子和氢原子构成 |
“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6 价的铬。下列铬的化合物中铬呈+6 价的是
| A.Cr2(SO4)3 | B.Cr2O3 | C.K2CrO4 | D.CrCl2 |