将1 mol 含镁物质的量分数为a的镁铝合金溶于含有b mol HNO3的稀溶液中,刚好完全反应,NO为唯一还原产物。向所得溶液中逐滴加入NaOH溶液至沉淀不再减少为止,将所得沉淀过滤、洗净、灼烧至恒重,所得固体质量与原合金质量相等。下列说法中正确的是
①合金含镁质量分数为60%②反应中放出气体体积在标准状况下为(1-a/3)× 22.4 L③反应过程中最大沉淀质量为(78-20a)g④反应中共消耗NaOH[b-(1-a/3)]mol
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列说法不正确的是
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
下列物质中能抑制水的电离且使溶液呈现出酸性的是:
| A.Na2CO3 | B.Al2(SO4)3 | C.K2SO4 | D.H2SO4 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: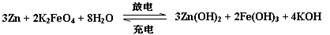 ,下列叙述错误的是:
,下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 | B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 | D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |